Den enklaste typen raka och förgrenade kolväten är alkanerna. De flesta andra kolväten (och därmed också merparten av alla andra organiska ämnen) får namn som bygger på vilka alkaner de liknar. Det kan därför vara bra att ha koll på dessa innan du går vidare med resten av den organiska kemin.
Raka alkaner
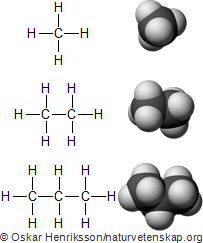 Den allra enklaste, raka alkanen är metan. Det är en gas vars molekyler består av en enda kolatom som binder till fyra väteatomer. Metan har alltså formeln CH4. Det är detta ämne som finns i naturgas (som är ett vanligt, fossilt bränsle).
Den allra enklaste, raka alkanen är metan. Det är en gas vars molekyler består av en enda kolatom som binder till fyra väteatomer. Metan har alltså formeln CH4. Det är detta ämne som finns i naturgas (som är ett vanligt, fossilt bränsle).
En annan mycket enkel alkan är etan. Skillnaden mot metan är att man har bytt ut en väteatom mot en ny kolatom som binder till ytterligare tre väteatomer. Formeln för detta ämne blir C2H6. Även etan hittar du i naturgas.
Man kan också lägga på ytterligare en kolatom. Kolvätet som man får då kallas propan och har summaformeln C3H8. Du hittar bland annat propan i gasolbrännare, som man har på de flesta laboratorium.
Som du märker är mönstret för raka alkaner väldigt enkelt. Man byter bara ut en väteatom i föregående alkans ände mot en ny kolatom med tre väteatomer. Och så här kan man fortsätta hur länge som helst – kolatom på kolatom kan läggas till och kedjan kan till slut bli flera hundra kolatomer lång.
Efter metan, etan och propan kommer nästa raka alkan, som kallas butan och som har fyra kolatomer. Kan du rita strukturformeln för detta ämne?
Klart du kan! Du utgår från propan som har strukturformeln

och lägger till en kolatom i ena änden, vilket ger oss butans strukturformel:
Längden bestämmer egenskaperna
Med längden förändras alkanernas egenskaper – ju längre molekyler, desto bättre håller de ihop med varandra och desto högre blir smält- och kokpunkten. Metan, etan och propan är gaser vid rumstemperatur, medan längre kolväten som heptan och oktan är vätskor. Kedjor som är ännu längre – till exempel heptadekan – är i fast form. I figuren nedan hittar du en lista över de elva enklaste (raka) alkanerna och vilken fas de befinner sig i vid normal temperatur och tryck.

Förgrenade alkaner
I översiktsartikeln om kolväten såg vi att kolväten också kan vara förgrenade och inte alltid formade som kedjor. Detta gäller även alkanerna.
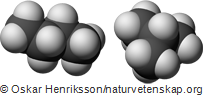 I bilden till höger visas molekylmodell för två butanmolekyler. Båda har lika många kol- och väteatomer men atomerna sitter ihop på ett lite annorlunda sätt. Detta medför att de två varianterna av butan inte får riktigt samma egenskaper – bland annat kok- och smältpunkten skiljer sig åt mellan de olika varianterna.
I bilden till höger visas molekylmodell för två butanmolekyler. Båda har lika många kol- och väteatomer men atomerna sitter ihop på ett lite annorlunda sätt. Detta medför att de två varianterna av butan inte får riktigt samma egenskaper – bland annat kok- och smältpunkten skiljer sig åt mellan de olika varianterna.
Molekyler som har samma antal av de olika atomslagen, men annorlunda struktur kallar kemister för isomerer. Det är viktigt att komma ihåg att nästan alla kolväten har flera isomerer, även om vi i våra artiklar främst behandlar de raka, kedjeformade.
Isomerer av samma ämne har samma summaformel (i de båda butanisomerernas fall C4H10). För att kunna visa vilken isomer av ett organiskt ämne man syftar på (exempelvis i en text) har varje isomer ett unikt namn. För att visa att det är den raka isomeren av butan man syftar på skriver man exempelvis normal-butan eller n-butan. Även förgrenade isomerer kan namnges, men hur det systemet fungerar går vi inte igenom förrän under gymnasiekemin.
Nedan visas strukturformler för två olika alkaner. Ta reda på vilka de är med hjälp av alkantabellen längre upp på sidan.

a) Det är en förgrenad kedja av fem kolatomer. Alltså är det en isomer av pentan.
b) Här har vi en annan förgrenad kedja, bestående av åtta kolatomer. Vi har alltså att göra med en oktan-isomer.
Alkaner är mättade
Japp, precis som rubriken lyder säger man att alkaner är mättade kolväten. Men vad betyder då detta? Jo, det innebär att alkanernas kolatomer håller ihop med så få bindningar som möjligt, vilket gör att de får maximalt många bindningar över till väteatomer. De är alltså ”mätta” på väteatomer.
Ett omättat kolväte däremot innehåller en eller flera dubbel- och trippelbindningar för att hålla ihop sina kolatomer, vilket gör att de får färre bindningar över till väteatomer. Den typen av kolväten berättar vi mer om i artikeln om alkener och alkyner.